2023年9月7日,北京呈诺医学科技有限公司顾雨春教授团队,以及英国阿斯顿大学医学院、英国剑桥大学干细胞研究所等研究团队,在神经领域期刊 GLIA 上发表了题为:Human iPSC-derived endothelial cells promote CNS remyelination via BDNF and mTORC1 pathway 的研究论文。马丹博士、张会远博士为该论文的共同第一作者。顾雨春教授、赵操教授为该论文的共同通讯作者。

据研究团队介绍,该研究利用iPSC诱导分化来源成熟内皮细胞,验证了其对毒素诱导的CNS脱髓鞘小鼠模型髓鞘再生的促进作用,显示iPSC来源内皮细胞拥有治疗髓鞘损伤诱发的相关CNS疾病的潜力。研究进一步发现,iPSC来源内皮细胞通过释放可溶性因子(如脑源性神经营养因子BDNF等),激活mTORC1信号通路介导少突胶质细胞谱系进展,进而促进髓鞘修复。此外移植物还被证明有助于促进小胶质细胞/巨噬细胞从促炎症M1向抗炎症M2表型极化转变,从而控制炎症发展。
髓鞘损伤是许多中枢神经系统(CNS)疾病发生的重要原因,包括多发性硬化症(MS)、创伤性损伤、神经退行性疾病、精神疾病等。髓鞘形成的失败最终会导致进行性神经元的丢失和不可逆的功能缺陷,因此,促进髓鞘再生成为一种潜在的有效临床干预措施。髓鞘再生主要涉及CNS中少突胶质前体细胞(Oligodendrocyte progenitor cells,OPCs)的激活和招募,其通过增殖、迁移并分化形成新的成熟少突胶质细胞,进而形成新的髓鞘。但目前临床上尚无直接促进髓鞘再生的治疗方法。
既往研究证实,人内皮细胞(Endothelial cells,ECs)能够通过细胞直接替代或相互间作用,改善心脏、肢体和大脑缺血性损伤后的组织修复。移植内皮细胞可通过增加少突胶质细胞谱系和神经元的数量促进脑白质缺血损伤的恢复。然而内皮细胞在CNS髓鞘再生过程中对少突胶质细胞谱系进展的影响,以及潜在机制还不清楚。
文章采用溶血卵磷脂注射至小鼠胼胝体诱导局灶性脱髓鞘病变模型,并在脱髓鞘损伤形成后完成iPSC来源内皮细胞的原位注射给药治疗。给药组小鼠脑部切片显示,iPSC来源ECs可在移植部位存活,并从移植部位向损伤胼胝体区域呈现明显迁移。相比模型组,移植iPSC来源ECs可以提高病变区域OPCs和/或少突胶质细胞的存活率以实现OPCs的招募富集,显著降低脱髓鞘病变进程的同时,加快少突胶质细胞谱系进展,最终促进病变区域髓鞘再生。(figure 6/7/8)
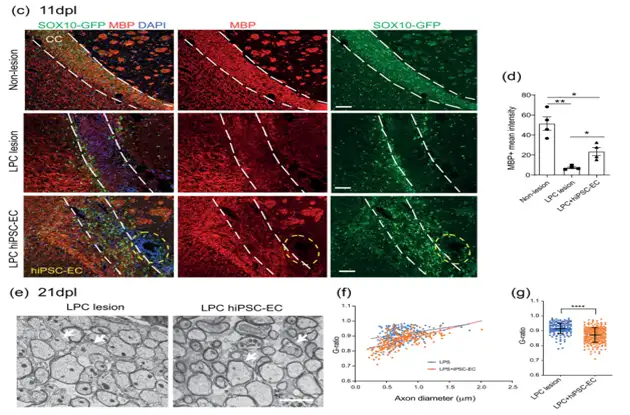
Figure 7. hiPSC-EC transplantation attenuates myelin damage and enhances remyelination after LPC induced demyelination.
既往机制研究指出,OPCs向成熟髓鞘少突胶质细胞的发展过程,涉及多种内在信号通路的复杂相互作用,包括MAP激酶通路、mTOR通路和Wnt信号通路,同时也会受到一系列外部因素的调控。脑微血管可通过其内部内皮细胞表达的信号分子调控OPC沿着其血管网络结构进行迁移,从而在髓鞘的发育和修复过程中发挥重要作用。脑部内皮细胞分泌的营养因子也可通过Akt和Src等信号通路促进OPC的存活和增殖。文章发现,通过iPSC分化所得内皮细胞同样具备丰富的旁分泌作用,并可显著促进OPCs的增殖、迁移和分化。进一步论证确认,分泌因子中的脑源性神经营养因子BDNF,通过介导mTROC1信号通路,在促进OPCs分化调控过程中发挥关键作用。(figure 3/4/5)
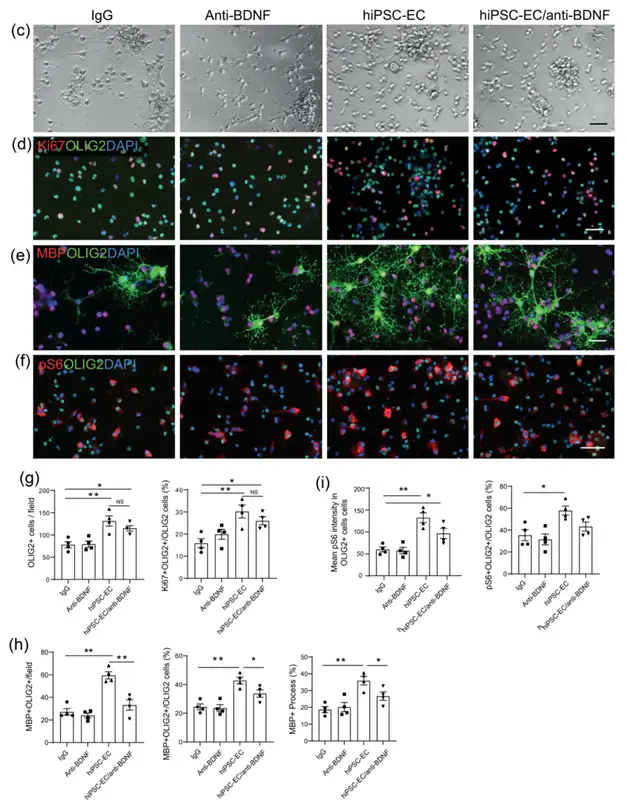
Figure 4. Involvement of brain derived neurotrophic factor (BDNF) and mTORC1 activation in hiPSC-EC mediated effects on OPCs.
该研究同样发现,相比模型组,iPSC来源ECs移植治疗组损伤区域内小胶质细胞/巨噬细胞的M2表型显著增加。髓鞘再生一般是由脱髓鞘区域微环境中的多种细胞类型共同策划的。脱髓鞘的发生会激活小胶质细胞/巨噬细胞,在清除髓鞘碎片的同时分泌各种细胞因子和生长因子,为OPCs产生少突胶质细胞创造有利环境,因此炎症反应在髓鞘再生中起着重要作用。不过,过度的炎症效应对其也是不利的。炎症反应后期,需要促使小胶质细胞/巨噬细胞从促炎症的M1表型向抗炎症的M2表型转换,从而降低炎症反应强度,可以说M1向M2表型的转换效率直接关系髓鞘再生结果。该研究证明移植物iPSC来源ECs有助于促进小胶质细胞/巨噬细胞从促炎症M1向抗炎症M2表型极化转变,显示较好的炎症控制能力,也是其促进髓鞘再生的关键机制之一。(胡晓生)
(以上专业材料由顾雨春教授团队提供。)