2024年5月17日,微谱正式收到来自美国食品药品监督管理局(FDA)的函件通知和现场检查报告,圆满通过FDA现场检查。这标志微谱医药实验室质量管理体系经FDA确认满足美国市场申报需要的GMP及相关法规要求,可持续为全球医药企业提供符合中美双报的项目报告。
常态化合规,高质量运营。目前,微谱着力打造的近30000㎡医药实验室正以满足NMPA、FDA、EMA、WHO等国家和区域的监管要求为基本准则,持续助力海内外医药客户高效推进中外多报项目的国际化进程!

▲ 图源 | FDA官网
2024年4月初,美国FDA专家对微谱医药实验室进行了专业的现场检查,关注重点涵盖质量体系合规性、项目数据一致性和可靠性等,对微谱医药实验室的质量体系、设施设备、控制系统及物料系统等进行了严谨细致的现场检查与综合评估。最终微谱医药实验室顺利通过FDA现场核查,协助客户产品顺利进军美国市场!

▲ 图 | 微谱医药实验室
此次顺利通过FDA现场检查,不仅表明了微谱医药实验室可以满足FDA cGMP质量管理体系的要求,更进一步证明了微谱早已拥有为医药企业持续提供中美双报项目报告的体系化专业能力。伴随更多医药企业加快国际化战略布局的脚步,微谱将持续打造满足NMPA、FDA、EMA、WHO等国家和区域的监管要求的服务平台,全速助力客户产品高效推进中美欧等项目多报。
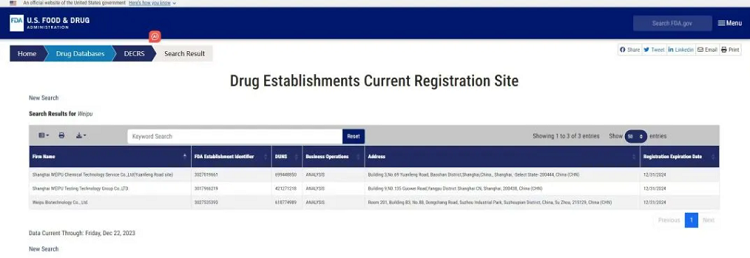
▲微谱医药实验室FDA备案2024版丨图源:FDA官网
持续进阶,稳健前行。微谱深耕医药领域十余年,始终坚持将高品质医药技术服务与系统化管理思维相结合。目前,我们已拥有近30000㎡的医药实验室,凭借丰富的项目经验、成熟的研究体系、迅捷的方法开发和快速的检测周期,持续助力药物及医疗器械产品缩短研发时长,降低研发成本,加速获批和上市进程,尽快兑现商业和社会价值。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。














